| NH4HSO4和H2SO4按物质的量比1:1混合溶于水配制成浸取液,220℃时可将高铝粉煤灰中Al2O3转化为硫酸铝铵[NH4Al(SO4) 2],然后分离、煅烧获得纯Al2O3。 查阅资料知硫酸铝铵:①溶解度:0℃时,S=5.2g;100℃时,S=421.9g 。②280℃时分解。 ①依据资料可知,将硫酸铝铵与其他溶质分离的方法是。 ②煅烧NH4Al(SO4) 2时发生4NH4Al(SO4)2  2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是(填化学式);试剂Y是(填名称),其中溶质的物质的量为。 2Al2O3+5SO3↑+3SO2↑+2NH3↑+N2↑+5H2O↑,得到混合气体(NH3、N2、SO2、SO3、H2O )。若16mol混合气体按如下装置被完全吸收制得浸取液。则右下图中,试剂X是(填化学式);试剂Y是(填名称),其中溶质的物质的量为。 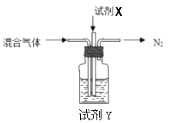 |