为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g.将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g.按下图连接好装置进行实验. 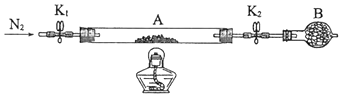
①仪器B的名称是. ②将下列实验操作步骤正确排序(填标号);重复上述操作步骤,直至A恒重,记为m3 g. a.点燃酒精灯,加热b.熄灭酒精灯c.关闭K1和K2 d.打开K1和K2 , 缓缓通入N2e.称量Af.冷却至室温 ③根据实验记录,计算绿矾化学式中结晶水数目x=(列式表示).若实验时按a、d次序操作,则使x(填“偏大”“偏小”或“无影响”). |