| I.常温下,浓度均为0.1 mol·L-1的下列五种水溶液的pH如下表:

上述盐溶液中的阴离子,结合质子能力最强的是。 |
| 根据表中数据判断,浓度均为0.01 mol·L-1的下列四种物质的溶液中,酸性最弱的是;将各溶液分别加水稀释100倍,pH变化最大的是(填字母)。
A.HCN B.HClO C.H2CO3 D.CH3COOH |
| 要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为。 |
| II.已知水在25℃和95℃时,其电离平衡曲线如图所示:
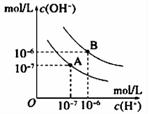
95℃时水的电离平衡曲线应为(选填“A”或“B”); |
| 25℃时,将pH=10的NaOH溶液与pH=6的盐酸溶液混合,若所得混合溶液的pH=7,则NaOH溶液与盐酸溶液的体积比为; |
| 95℃时,若1体积pH=a的某强酸溶液与10x体积pH=b的某强碱溶液混合后溶液呈中性,则混合前,a与b之间应满足的关系是。 |