| I.探究反应产生的气体成分。
经检验反应产生的气体有H2 , 实验室检验H2的方法为。 |
小组成员认为反应产生的气体中可能有CO2 , 并对此进行了如下实验(图1、图2中曲线②均为对应加入镁条的数据):
|
实验序号
|
实验操作
|
|
2
|
分别称取两份6.0 mL 1 mol·L-1NaHCO3溶液于两个相同塑料瓶中(其中一个加入0.1g镁条),塞紧CO2气体传感器,采集数据,各重复实验1次,得到图1所示曲线
|
|
3
|
分别称取两份30.0 mL 1 mol·L-1NaHCO3溶液于两个相同烧杯中(其中一个加入1.1g镁条),插入pH传感器,搅拌并采集数据,得到图2所示曲线
|
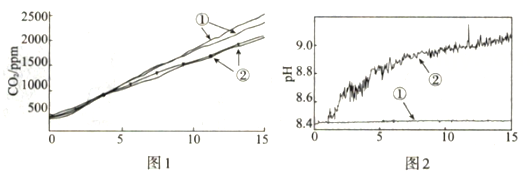
图1中曲线②对应的CO2含量逐渐增大的原因为 (用化学方程式表示);结合实验3解释,随着时间推移,图1中曲线②的数值低于曲线①的原因为。 |
| II.探究Mg与NaHCO3溶液反应比与热水反应快的原因。
小组成员推测可能是溶液中的Na+或HCO 加快了该反应的发生,对比实验1设计实验如下: 加快了该反应的发生,对比实验1设计实验如下:
|
实验序号
|
实验操作
|
实验现象
|
|
4
|
向 溶液中加入长3 cm的镁条
|
持续快速产生大量气泡,溶液略显浑浊
|
结合实验1和4,可知溶液中的HCO 加快了反应的发生。 加快了反应的发生。
①实验4中横线处内容为。
②查阅文献可知,Mg(OH)2质地致密,MgCO3质地疏松,请结合必要的文字和化学用语解释HCO 能加快该反应的原因为。 能加快该反应的原因为。 |
| III.探究固体浑浊物的组成。
文献显示,固体浑浊物为Mg(OH)2和MgCO3的混合物。甲、乙两位同学设计不同方案,测定混合物组成。
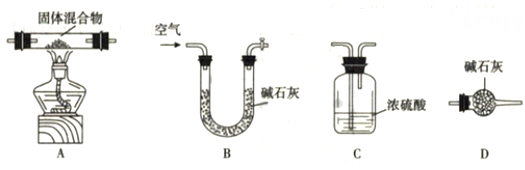
甲同学借助下图装置(可重复选用),通过测定固体热分解产物水及二氧化碳的质量,测定其组成。按照该方案,装置的连接顺序为(填字母编号)。
|
| 乙同学只测定了固体浑浊物在热分解前后的质量分别为3.42 g和2.00g,据此计算出固体浑浊物中n[Mg(OH)2]:n[MgCO3]=。 |