| (探究一)无水AlCl3的实验室制备
利用下图装置,用干燥、纯净的氯气在加热条件下与纯铝粉反应制取无水AlCl3。供选择的药品:①铝粉②浓硫酸③稀盐酸④饱和食盐水⑤二氧化锰粉末⑥无水氯化钙⑦稀硫酸⑧浓盐酸⑨氢氧化钠溶液。
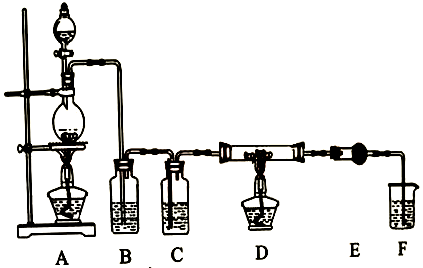 写出装置A发生的反应方程式。 |
| 装置E需用到上述供选药品中的(填数字序号),装置F的作用是。 |
| 写出无水AlCl3遇到潮湿空气发生反应的化学方程式。 |
| (探究二)离子浓度对氯气制备的影响
探究二氧化锰粉末和浓盐酸的反应随着盐酸的浓度降低,反应会停止的原因:
提出假设:假设1.Cl-浓度降低影响氯气的生成;假设2.。 |
设计实验方案:(限选试剂:浓H2SO4、NaCl固体、MnO2固体、稀盐酸)
|
步骤
|
实验操作
|
预测现象和结论
|
|
①
|
往不再产生氯气的装置中,加入继续加热
|
若有黄绿色气体生成,则假设1成立
|
|
②
|
|
若有黄绿色气体生成,则假设2成立
|
|
| (探究三)无水AlCl3的含量测定及结果分析
取D中反应后所得固体2.0g,与足量氢氧化钠溶液反应,测定生成气体的体积(体积均换算成标准状况),重复测定三次,数据如下:
|
|
第一次实验
|
第二次实验
|
第三次实验
|
|
D中固体用量
|
2.0g
|
2.0g
|
2.0g
|
|
氢气的体积
|
334.5mL
|
336.0mL
|
337.5mL
|
根据表中数据,计算所得固体中无水AlCl3的质量分数。 |
| 有人认为D中制得无水AlCl3的质量分数偏低,可能的一种原因是。 |