“萃取”时存在反应:Ce4+ +n(HA)2  Ce·(H2n-4A2n)+4H+。 Ce·(H2n-4A2n)+4H+。①实验室中萃取时用到的主要玻璃仪器为烧杯和。 ②如图,D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比( 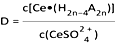 )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。 )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。
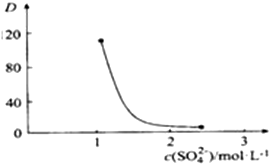
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2 , 充分振荡,静置,水层中c(CeSO42+)=。 (结果保留三位有效数字) |